On a tendance à l’oublier, mais le virus qui occupe désormais une partie de presque toutes les discussions n’est pas le seul à exister, loin de là ! Ce n’est pas non plus le seul dont l’origine demeure mystérieuse et complexe… Petite illustration ici de l’étrange monde viral, entre investigations dignes d’une enquête policière, travail d’historien et fouille archéologique de « fossiles » viraux…
Voilà plus de deux ans déjà qu’on nous rabâche à longueur de journée des histoires de virus : LA/LE Covid19, Coronavirus, SARS-COV2, et j’en passe (liste non exhaustive). On pourrait presque l’oublier, mais bien d’autres virus existent à la surface de notre globe (voir même au plus profond des génomes de nombreuses espèces, y compris chez Homo sapiens… Mais ça, c’est une autre histoire !). Environ 5 000 espèces différentes ont déjà été décrites par les scientifiques, ce qui représente paraît-il environ 1031 entités virales existant sur Terre1 (10 000 000 000 000 000 000 000 000 000 000, c’est-à-dire beaucoup, vraiment beaucoup)… Pour changer un peu, j’aimerai aujourd’hui vous raconter l’histoire ô combien mouvementée d’autres virus, qui sont quant à eux responsables de la Réticuloendothéliose (appelons-les les VRs) !
Déjà, la Réticuloendothéliose, c’est quoi ?
Il s’agit d’une maladie touchant exclusivement les Oiseaux, et plus spécifiquement les Galliformes (comprendre les poules, dindes, faisans, perdrix, etc.) ainsi que les Anscriformes (soient les canards !). Une infection causée par ces virus est responsable de toute une série de symptômes peu avenants pour les malheureux individus touchés : anémie (un manque d’hémoglobine dans le sang), immunodépression (une diminution globale des défenses immunitaires), néoplasie (formation de kystes par exemple), retard de croissance ou encore le symptôme dit « nakanuke » (troubles de la formation du plumage)1.

Qui sont les responsables de cette maladie ? Il s’agit d’un ensemble de virus appartenant à la famille des rétrovirus, ou Retroviridae (je vous l’avais dit, point de Coronavirus ou autres Coronaviridae ici… Ça nous change !). La caractéristique remarquable de ces virus (à ARN eux aussi…) vient de leur habilité à pouvoir insérer une copie sous la forme d’ADN de leur génome dans celui des cellules infectées de l’hôte. Cette copie insérée est alors appelée « virus endogène » (ou ERV pour Endogenous RetroViruses). Dans une faible proportion de cas, si cet ERV se retrouve au sein de cellules particulières, celles qui appartiennent à la lignée dite « germinale » (c’est-à-dire l’ensemble des cellules se différenciant à terme en spermatozoïdes ou en ovules), alors il est possible/probable que cet ERV soit transmis à la génération suivante de l’hôte… Se maintenant ainsi dans le génome de l’espèce hôte, telle une empreinte fossile du virus libre, qui aurait été piégée dans le génome de son hôte2… Et cette caractéristique aura son importance par la suite…
Une origine étrange pour un passager clandestin…
Une fois les virus responsables de cette maladie isolés et identifiés, des études précédentes ont pu démontrer qu’ils étaient fortement apparentés à des ERVs (donc des fossiles de virus intégrés dans le génome de leur hôte) présents dans le génome d’une espèce d’Echidné (répondant au doux nom de Tachyglossus aculeatus) : une espèce appartenant aux Mammifères, vivant en Australie et en Nouvelle-Guinée, et réputée pour pondre des œufs ! Une autre bizarrerie naturaliste venue d’Australie donc… Suggérant ainsi que ces virus, qui infectent actuellement des Oiseaux, ont peut-être été présents chez des Mammifères avant de toucher nos amis à plumes3,4 !

Comment passer des Mammifères aux Oiseaux ?
Car là on ne parle pas d’un virus dont on a pu suspecter un transfert du pangolin (ou de la chauve-souris) vers Homo sapiens, c’est-à-dire d’un Mammifère vers un autre Mammifère… Ici, les VRs seraient passés des Oiseaux aux Mammifères, ce qui représente un « saut d’hôte » bien plus conséquent ! Et par ailleurs, d’autres complices ont-ils pu servir de passeur dans cette histoire ? Pour répondre à cette question, les biologistes ont consulté les banques de données publiques disponibles et se sont aperçus que des fragments dérivés des VRs étaient présents au sein des génomes de 2 autres virus, bien plus gros, pouvant infecter naturellement les Oiseaux : (i) le virus Fowlpox5 responsable de la formation de plaies notamment au sein des voies respiratoires et digestives ; (ii) et le gallid herpesvirus 26 responsable de la maladie de Marek, causant la formation de kystes et pouvant paralyser les Oiseaux infectés (conduisant à la mort de l’individu, on s’en doute…).
Donc si on refait le bilan de cette Réticuloendothéliose, nous avons les observations suivantes : (i) les VRs sont responsables de la maladie et peuvent s’insérer dans les génomes de leurs hôtes ; (ii) des fossiles de ces VRs ont été identifiés au sein de Mammifères ; (iii) des fossiles de ces VRs sont aussi présents chez 2 autres virus infectant des Oiseaux….
Que s’est-il donc passé sur cette étrange scène de crime ?
Première piste : les génomes de Mammifères
Sachant que nos virus peuvent s’intégrer dans les génomes (i), et que des « fossiles » ont d’ores et déjà été détectés au sein de génome de Mammifères dans la seconde moitié des années 1990, les chercheurs ont profité de l’extension considérable des banques de données de génome publique pour savoir si d’autres fossiles pouvaient être identifiés. Ils utilisèrent ainsi des outils informatiques de plus en plus puissants et complexes sur des données concernant non seulement les Mammifères, mais aussi les Oiseaux. Ainsi, une fouille a été effectuée dans 52 génomes (42 de Mammifères, pour 10 d’Oiseaux)… La suite logique de cette fouille fut ensuite de classer les « fossiles » identifiés par leur relation d’apparentement, faire une sorte d’arbre généalogique des séquences récupérées (on parle de phylogénie). A la grande surprise des chercheurs, les « fossiles » les plus proches des virus d’Oiseaux n’ont pas été détectés au sein des génomes d’Oiseaux, mais bien au sein de ceux des Mammifères…
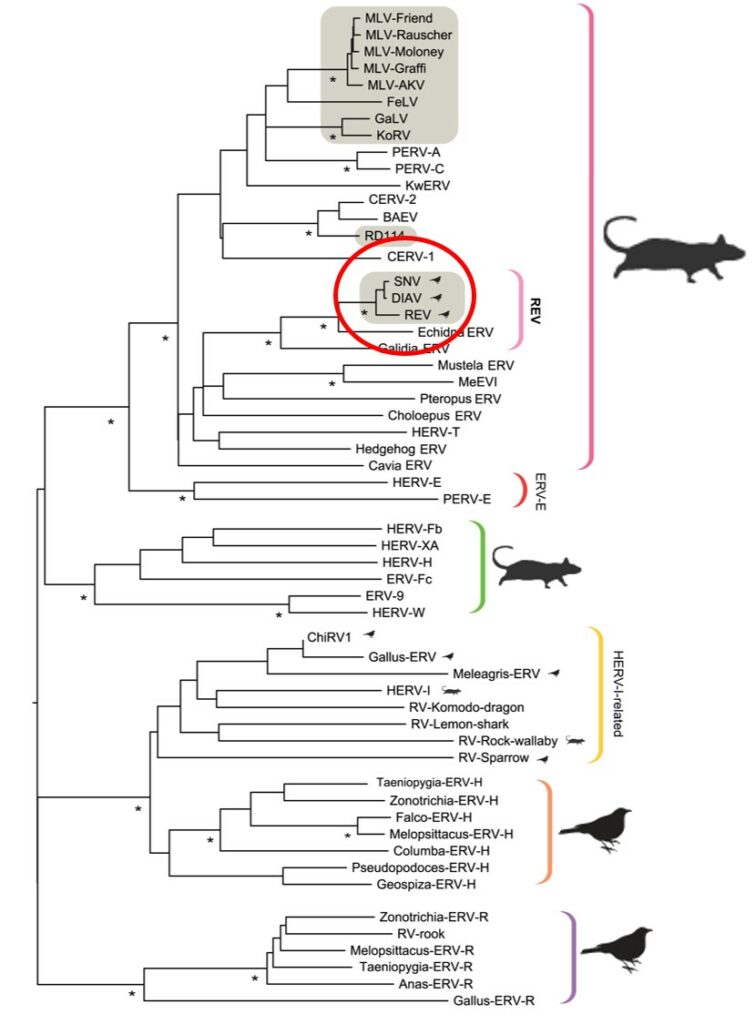
Grâce à des approches statistiques et probabilistes assez techniques et avancées (dont je passerai les détails ici), les chercheurs ont même été capables d’estimer à quelle époque ces fossiles se sont établis dans les génomes étudiées ! Et ces premières analyses révélaient clairement que l’ensemble des VRs sont issus d’un ancêtre commun, circulant au sein des populations de Mammifères il y a 23 à 25 Millions d’années… Pour vous donner une idée de l’échelle de temps dont on parle ici, les Dinosaures que nous connaissons tous ont disparu il y a environ 65 Million d’années… Ces analyses ont aussi permis de confirmer cette première suspicion : les VRs actuels d’Oiseaux étaient bien au départ des virus touchant les Mammifères ! A présent la question suivante apparaît assez naturellement : mais comment ces VRs se sont-ils retrouvés chez les Oiseaux ?
Investigations historiques et arrivée d’un ultime clandestin : Plasmodium lophurae
Afin d’éclaircir le mystère précédent, les chercheurs se sont focalisés par une recherche historique sur l’ensemble des épidémies de VRs s’étant déroulées et étant archivées. De cette fouille historique, ils n’ont pu récupérer qu’un seul échantillon de sang (de canard) contaminé par des VRs … C’est fort peu bien sûr, mais bien mieux que rien ! Il s’avère que ces échantillons étaient issus de canards expérimentalement infectés par un parasite : Plasmodium lophurae, afin d’étudier le fonctionnement de ce dernier. Les organismes -on parle de Protozoaires- du genre Plasmodium sont tous connus pour être des parasites ou d’Insectes, ou de Vertébrés. Par exemple, 5 espèces de Plasmodium sont connues pour être responsables du paludisme chez Homo sapiens (principalement l’espèce P. falciparum7).
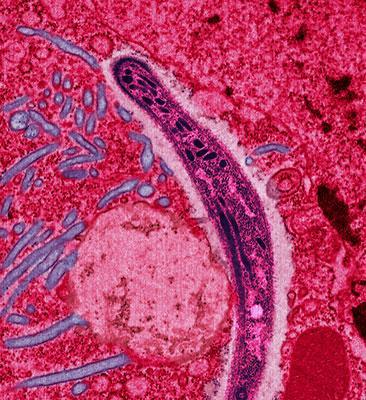
Les rapports de l’époque, datés des années 1950, indiquent clairement que la présence des VRs au sein de ces échantillons de sang de canard était due à la présence de P. lophurae contaminés par les VRs! Une première porte d’entrée des VRs chez les Oiseaux semble ainsi émerger… Pour la petite histoire : ce cher P. lophurae a été isolé une unique fois, au cours du mois de Juin 1937 par Lowell T. Goggeshall dans le zoo de Brooklyn, qui cherchait alors à découvrir de nouveaux modèles biologiques permettant d’étudier les agents pathogènes responsables de la malaria (maladie connue aussi sous le nom de paludisme). A partir des années 1940, les rapports indiquent que les maladies développées par des Oiseaux expérimentalement infectés n’étaient pas causées par un unique effecteur, P. lophurae seul n’expliquant pas l’ensemble des symptômes déclarés8… Plutôt logique, puisque les fauteurs de troubles étaient les VRs en question ! Malheureusement, les stocks disponibles de P. lophurae ont cessé d’être utilisables dans les années 1980, et ce pathogène n’a jamais pu être isolé à nouveau depuis lors… La question de savoir comment P. lophurae et les VRs ont été mis en contact demeure encore un mystère, même si les chercheurs semblent privilégier un contact ayant eu lieu au sein du zoo de Brooklyn…
Des virus qui s’intègrent dans d’autres virus !
Bon, d’une part il est clair que nos VRs sont originaires des Mammifères. D’autre part, il existe (ou a existé) un vecteur possible expliquant le transfert d’hôte des Mammifères aux Oiseaux par l’intermédiaire d’un autre pathogène, le disparu P. lophurae. Néanmoins, comment des fragments de VRs se sont-ils intégrés dans les génomes des virus Fowlpox et du gallid herpesvirus 2, comme indiqué précédemment au cours de cette enquête ?
Que nous dit l’histoire quant à ces 2 virus ? Y-a-t-il un lien possible avec Plasmodium ? Ce dernier constituait une priorité de recherche pour les États-Unis au cours de la Seconde Guerre Mondiale, époque à laquelle plusieurs stocks de P. lophurae furent distribués aux laboratoires de recherche publique (l’idée était de permettre le développement de traitements médicamenteux ou vaccinaux contre le paludisme…). Dans le même temps, tandis que l’élevage de poules/poulets était de plus en plus important, le premier vaccin aviaire (qui comprenait une vaccination contre Fowlpox) venait d’être commercialisé… A partir d’un unique échantillon lyophilisé disponible et daté de 19499, les chercheurs ont pu identifier la présence de fragments de VRs au sein de ce vaccin, indiquant que l’intégration s’est déroulée avant la mise au point du vaccin… Y-a-t-il eu une mise en contact accidentelle entre P. lophurae, le virus Fowlpox et les VRs sur cette même période ? Impossible à affirmer, mais impossible de ne pas considérer cette hypothèse pour autant !
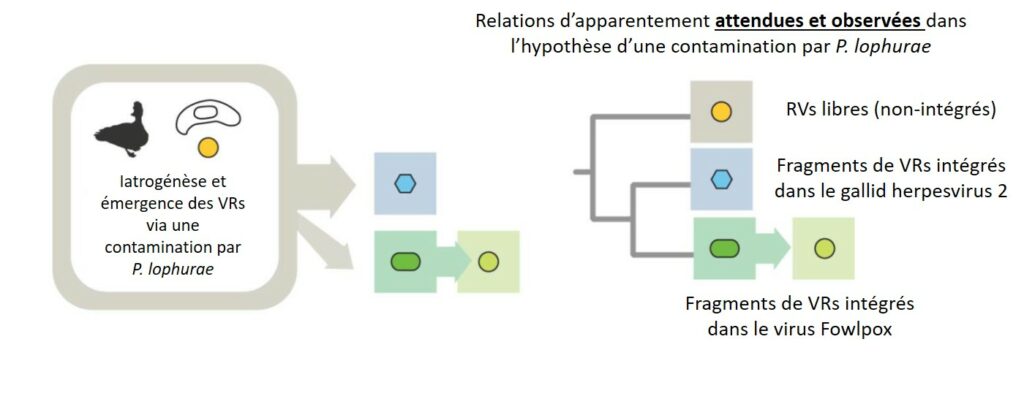
Concernant le gallid herpesvirus 2, ce dernier a été largement étudié à partir des années 1950 puisqu’il était responsable d’épidémies dévastatrices chez les Oiseaux d’élevage aux Etats-Unis10. Un vaccin n’a guère pu être mis au point avant les années 1960, lorsque des cultures de cellules d’Oiseaux ont également été développées… Et, fait surprenant, ces cultures cellulaires étaient déjà contaminées par la présence de VRs ! Expliquant la mise en contact entre ces VRs et le gallid herpesvirus 2 ! Mais comment ces VRs ont-ils pu contaminer les cultures de cellules alors utilisées ? Car il apparaît certain que l’émergence des cultures cellulaires d’Oiseau a participé à la propagation des VRs…
Malheureusement pour ce long récit, le fin mot de l’histoire n’a pas encore été totalement trouvé… Les pistes sont là, mais retracer l’histoire entière avec précision risque d’être une tâche ardue (les échantillons historiques étant manquants pour mieux comprendre, de plus impossible de retrouver des P. lophurae désormais…). L’hypothèse privilégiée ici reste l’intervention de ce passager clandestin que fut Plasmodium pour faciliter le passage d’hôte Mammifères vers hôte Oiseaux, « grâce » à l’intervention et aux tentatives de mise au point de vaccins par Homo sapiens. Dans un tel cas, on peut parler du terme iatrogénèse (puisque les scientifiques adorent les mots compliqués), qui correspond à l’ensemble des conséquences néfastes sur la santé à partir d’un acte médical (qui était censé améliorer la santé du patient !).
La morale de cette histoire ?
A présent, prenons un peu de hauteur quant à l’histoire que je viens de vous compter… Je pense que tous ceux ayant eu la patience de s’accrocher jusqu’ici auront compris la difficulté et la complexité de retracer l’histoire d’une maladie, de son émergence à sa propagation. Entre le travail de fourmis d’investigation historique, des analyses parfois complexes en elles-mêmes, l’absence de certains échantillons perdus dans les limbes du temps, l’existence de nouveaux acteurs inattendus… Pas simple d’y voir clair ! Cette histoire (publiée en 2013 déjà) illustre et souligne à merveille la plasticité et l’adaptabilité dont sont capables les virus… Un léger coup de pouce peut être suffisant pour leur permettre de se transférer entre 2 hôtes parfois très différents (l’ancêtre commun des Oiseaux et des Mammifères datant d’au moins 300 millions d’années11, ces 2 groupes se sont donc séparés il y a très longtemps…), et ce en très peu de temps puisque le « crime » semble avoir été réalisé dans la première moitié du XXème siècle. Un simple grain de sable peut déclencher une cascade d’évènements qu’il est bien ardu de retracer… Je terminerai enfin par les termes employés par les auteurs de cet article, qui concluent d’ailleurs sur des recommandations qui peuvent nous paraître évidentes aujourd’hui :
« Broader surveillance of viral genetic diversity should be prioritized, so that the unintended consequences of experimental procedures on viral ecology and evolution can be better assessed and limited. »
Intéressant, non ?
Pour ceux que l’anglais (très) technique ne rebute pas, vous pourrez retrouver l’article d’origine en accès libre à ce lien. Un article publié dans le journal PLOS Biology en Août 2013 et écrit par Anna Maria Niewiadomska et Robert J. Gifford.
Références bibliographiques
- Microbiology by numbers. Nat. Rev. Microbiol. 9, 628–628 (2011).
- Nair, V., Zavala, G. & Fadly, A. M. Reticuloendotheliosis. Dis. Poult. 593–604 (2013).
- Weiss, R. A. The discovery of endogenous retroviruses. Retrovirology 3, 1–11 (2006).
- Martin, J., Herniou, E., Cook, J., O’Neill, R. W. & Tristem, M. Interclass transmission and phyletic host tracking in murine leukemia virus-related retroviruses. J. Virol. 73, 2442–2449 (1999).
- Barbacid, M., Hunter, E. & Aaronson, S. A. Avian reticuloendotheliosis viruses: evolutionary linkage with mammalian type C retroviruses. J. Virol. 30, 508–514 (1979).
- Hertig, C., Coupar, B. E., Gould, A. R. & Boyle, D. B. Field and vaccine strains of fowlpox virus carry integrated sequences from the avian retrovirus, reticuloendotheliosis virus. Virology 235, 367–376 (1997).
- Isfort, R. J., Witter, R. & Kung, H. Retrovirus insertion into herpesviruses. Trends Microbiol. 2, 174–177 (1994).
- Mendis, K., Sina, B. J., Marchesini, P. & Carter, R. The neglected burden of Plasmodium vivax malaria. Am. J. Trop. Med. Hyg. 64, 97–106 (2001).
- Terzian, L. A. Studies on Plasmodium lophurae, a Malarial Parasite In Fowls. I. Biological Characteristics. Am. J. Hyg. 33, (1941).
- Kim, T.-J. & Tripathy, D. N. Reticuloendotheliosis virus integration in the fowl poxvirus genome: not a recent event. Avian Dis. 663–669 (2001).
- Burmester, B. R. & Purchase, H. G. The history of avian medicine in the United States V. Insights into avian tumor virus research. Avian Dis. 23, 1–29 (1979).
- Benton, M. J. & Donoghue, P. C. J. Paleontological evidence to date the tree of life. Mol. Biol. Evol. 24, 26–53 (2007).