Voilà plusieurs mois désormais qu’émergent régulièrement aux infos les termes de « vaccins à ARN ». Cette technologie basée sur l’ARN messager, est utilisée actuellement pour des vaccins développés en réponse à l’épidémie de SARS-Cov2. Si elle apparaît comme « nouvelle » aux yeux du grand public, qu’en est-il réellement ? D’où sortent donc ces procédés ? Une petite revue historique s’impose…
Voilà près d’un an désormais que nous entendons ou voyons régulièrement aux infos les termes de « vaccins à ARN ». Cette technologie, se basant sur l’ARN messager (ARNm pour les intimes), est utilisée actuellement dans 2 vaccins développés en réponse à l’épidémie de SARS-Cov2 : les vaccins développés par Pfizer/BioNTech et Moderna1. Si cette technologie apparaît comme « nouvelle » aux yeux du grand public, qu’en est-il réellement ? D’où sortent donc ces procédés ? Une petite revue historique s’impose…
Déjà un vaccin, c’est quoi ?
Un vaccin, on sait tous en quoi cela consiste… Si on reprend une des définitions les plus classiques, un vaccin est une préparation biologique injectée à un organisme afin de stimuler/d’entraîner son système immunitaire, développant ainsi une immunité adaptative (comprendre une protection) durable dans le temps à l’encontre d’un agent pathogène responsable d’une maladie précise. Le principe de la vaccination (exposer un organisme à un pathogène pour l’en immuniser), appelé alors inoculation, est assez ancien et remonte bien avant Louis Pasteur… En effet, dès le XVIème en Chine, une pratique consistait à exposer des personnes à une forme (espérée) peu virulente de la variole afin de protéger ces mêmes personnes2 ! On ne parle pas encore du mot « vaccin » mais on s’en approche… A tel point d’ailleurs que le mot « vaccin » vient du terme anglais « vaccine », qui signifie la « variole de la vache » (et pour l’anecdote comme je parle latin couramment, on peut relever que le terme « vacca » veut dire « vache » en latin3…) !
C’est seulement quelques centaines d’années plus tard que Pasteur, Roux, Thuillier ou encore Chamberlan ont pu décrire cette technique d’atténuation des germes, menant à la première vaccination d’un troupeau de mouton contre la maladie du charbon en 18814. C’est ainsi qu’on parle de vaccin aujourd’hui !

ARN messager, les choses se compliquent…
A présent que nous savons de quoi l’on parle en utilisant le terme « vaccin », qu’en est-il de ces vaccins dits à « ARN messager », « ARNm » ou encore le plus souvent raccourci « ARN » ? De quoi parle-t-on réellement, concrètement ici ? Pour ça il faut bien comprendre ce qu’est tout d’abord l’ADN, pour pouvoir ensuite saisir le rôle et le fonctionnement de l’ARN. De plus, dans le cadre qui nous intéresse ici, je vais me concentrer sur l’ARN messager, car il en existe bien d’autres types… Sur ces précisions, en avant pour une analogie bancale :
L’ADN, ou Acide DésoxyRibonucléique, c’est un peu comme le papier et l’encre qui ont servi à faire le plan du meuble suédois que l’on souhaite construire, ce meuble suédois représentant un être vivant. Ce papier et cette encre sont constitués d’éléments (de briques) que l’on appelle des acides nucléiques (les fameuses « bases » de l’ADN, codifiées en A, C, G ou T). Les instructions qui vont nous guider dans la création de notre meuble, ce sont les gènes. Car l’encre et le papier (ADN), selon comment ils sont organisés, ont une signification, sont porteurs d’une information (gène). A partir de ces instructions, nous serons capables d’assembler les différentes pièces pour fabriquer des éléments de notre meuble, éléments aux fonctions multiples (tiroir, serrure, poignée ou autre…), ainsi que les outils pour réaliser ce même meuble (marteau, tourne-vis, etc.). L’ensemble de ces outils et de ces éléments constitue que l’on appelle des protéines, qui sont composées d’acides aminés. Après avoir lu l’ensemble des instructions et procédé à l’assemblage des différentes pièces et éléments, on obtient donc notre fameux meuble (être vivant) ! Suite à cette analogie approximative, le rôle de l’ARN se situe à la jonction entre les gènes (acides nucléiques) et les protéines (acides aminés). L’ARN messager sert de transition entre l’instruction à effectuer (le gène porté par l’ADN) et vis-à-vis des éléments (protéines) à assembler. L’ARN est une transcription passagère et éphémère de l’ADN, qui sera ensuite traduit en protéines. Le choix des mots n’étant pas anodin, pour davantage d’informations sur ces mécanismes, je vous renvoie vers vos moteurs de recherche préférés afin d’y chercher les termes associés de « transcription » et de « traduction ». Bref, il s’agit d’un intermédiaire à faible durée de vie (de quelques minutes à peine à quelques jours tout au plus au sein de cellules de Mammifères5… Vous vous souvenez de l’histoire des commandes de congélateurs allant à -80°C 6? C’est pour ça !) permettant la synthèse de protéines.

S’agit-il d’une découverte récente ? Eh bien l’Acide RiboNucléique (ARN) a été découvert dès le milieu du XIXème siècle7, et son rôle comme intermédiaire de la production de protéines (les fameux ARN messagers) a été théorisé et prouvé en 19618,9. Donc l’ARNm, le biologiste des années 2020 le connait bien, et depuis longtemps (car oui, il y a 60 ans en Science, ça fait déjà un bon paquet d’années…).
Vaccins OK, ARNm OK, Vaccins à ARNm ?
Bon maintenant que nous savons ce qu’est un vaccin, tout en connaissant le rôle de l’ARNm, pourquoi associer les 2 ?
Le tout premier « vaccin » à base d’injection d’ARNm a été réalisé dès 1971, lorsque des biologistes eurent l’idée étrange d’injecter des ARNm extraits de lapins à des œufs de grenouilles10… Au-delà de cette recette qui n’est pas sans rappeler une formule de potion magique peu ragoutante, les chercheurs ont alors constaté qu’après injection de l’ARNm de lapin dans les œufs, ces derniers produisaient des protéines de lapin… Des œufs de grenouille produisant des protéines de lapins ! Même constat 7 ans plus tard (1978 si vous suivez) lorsque de l’ARNm de lapin a été injecté dans des cellules de souris11. Nous ne sommes pas encore au développement d’un vaccin, mais le principe est là…
Arrivent alors les années 1990, et avec elles la naissance du mariage entre ARNm et vaccins. En 1993, l’injection d’ARNm codant pour une protéine du virus Influenza (responsable de la grippe !) a permis l’induction d’une réponse immunitaire chez la souris12. Même résultat 1 an après avec l’injection de d’ARNm codant pour une protéine du virus de la Forêt de Semliki chez la souris13. Quelques années plus tard, des ARNm issus de cellules cancéreuses de souris ont été injectés chez d’autres souris saines, déclenchant une réponse immunitaire protectrice vis-à-vis de la production de cellules cancéreuses14,15. Les vaccins à ARNm sont enfin nés ! Et ce environ 30 ans après la découverte du rôle des ARNm… Les années 2000 ont vu le perfectionnement de ces vaccins, et leurs premières applications sur cultures de cellules humaines16,17, avant que des essais concernant des maladies récentes (Influenza/Grippe A, Ebola, H1N1, Zika, et d’autres mots qui font peur) ne soient réalisés sur des modèles Vertébrés18–22 (cochon, souris, singes, etc.), suivi des premiers tests sur humains23,24 (dont un déjà développé à l’époque par Moderna24 dès 2017).
Pour ceux qui l’avaient manqué, une vaccination à partir d’ARNm, ça marche comment ?
Le principe global d’un vaccin est d’injecter chez le patient un corps étranger (de préférence d’origine pathogène, histoire d’être protégé ! Et oui c’est quand même le but de l’opération…) qui sera ensuite reconnu par notre système immunitaire qui va générer des anticorps. Ces derniers, spécifiques vis-à-vis du corps étranger car générés sur-mesure, vont se fixer spécifiquement sur le pathogène si celui-ci est toujours là, et vont agir tels des phares dans la nuit, attirant ainsi à eux les cellules immunitaires (les « globules blancs », ou si l’on est plus spécifique, les lymphocytes) qui vont pouvoir cibler le pathogène et s’en débarrasser. Voilà pour faire très court et de façon schématique le fonctionnement de l’immunité acquise, permettant une immunisation dans le temps puisque notre organisme « se souvient » des anticorps qu’il a utilisé, et peut les ressortir ainsi bien plus aisément lors d’une nouvelle infection.
Ici le corps étranger injecté est un ARNm étranger, qui va (tel est son rôle d’ARN) permettre la synthèse de protéines étrangères correspondantes. Celles-ci seront alors reconnues comme étant étrangères à l’organisme, qui va alors générer des anticorps, qui permettront enfin une réponse immunitaire efficace et rapide en cas de nouvelle infection, une fois les protéines étrangères « enregistrées ». Si je reprends l’analogie du meuble suédois, les vaccins « classiques » consistent à injecter un meuble suédois détruit (un virus inactivé), en morceau, afin qu’il soit reconnu par notre organisme, qui va finalement s’en trouver immunisé. Dans le cadre des vaccins à ARN, seuls quelques instructions pour des outils ou éléments du meuble sont injectés, permettant à terme la reconnaissance partielle du meuble en cas de nouvelle infection…
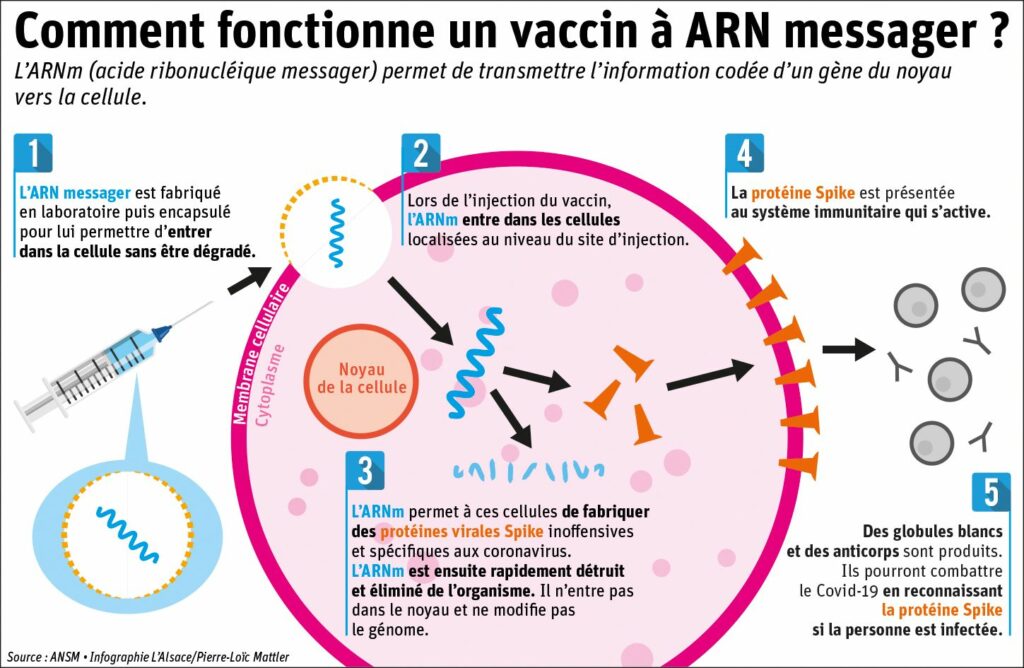
Ici, l’ARNm injecté code pour la fameuse protéine Spike25. Cette protéine joue un rôle central pour le virus, puisqu’elle est non seulement impliquée dans la reconnaissance et la fixation du virus aux cellules de l’hôte infecté, mais en plus elle permet de faciliter la libération du virus une fois la cellule infectée mourante… Ainsi, reconnaître cette protéine Spike, c’est reconnaitre le virus porteur de cette protéine, et donc s’en immuniser par la suite.
Bilan des courses
Vous l’aurez compris, les récents vaccins à ARNm sont les premiers du genre, mais ils n’ont pas été créés du jour au lendemain pour autant. La recherche fondamentale des années 1970 a ouvert la voie au développement de vaccins dans les années 1990, à leur optimisation dans les années 2000, aux essais cliniques à la fin des années 2010, et au développement de vaccins contre le SRAS-CoV-2 au début des années 2020. Si l’application de tels procédés est nouvelle sur Homo sapiens, notamment à une telle échelle (à l’heure actuelle, près de 50 millions de français ont reçu 2 doses de vaccin), la technologie utilisée demeure finalement assez ancienne, comme détaillé dans ce billet… D’ailleurs, la technologie à ARNm est plus ancienne que la technologie de la PCR et de ses dérivés, qui est née seulement à la toute fin des années 198026 !
À voir désormais à quel point et à quelle échelle de temps seront efficaces ces vaccins (à l’échelle populationnelle), même si la vaccination ne peut être pleinement efficace que si la majorité des personnes sur Terre (et pas que dans nos contrées) est aussi immunisée dans le même temps, limitant ainsi potentiellement l’émergence de nouveaux variants.
Mais ça, c’est déjà une autre histoire…
Références bibliographiques
- Pfizer et BioNTech annoncent que leur candidat-vaccin contre le Covid-19 est « efficace à 90 % ». Le Monde.fr (2020).
- Berche, P. Une histoire des microbes. (J. Libbey Eurotext, 2007).
- Pommier, F. Le mot ‘vaccin’. https://www.franceinter.fr/societe/le-mot-vaccin (2009).
- Pasteur, L., Chamberland, & Roux. Summary report of the experiments conducted at Pouilly-le-Fort, near Melun, on the anthrax vaccination, 1881. Yale J Biol Med 75, 59–62 (2002).
- Yu, J. & Russell, J. E. Structural and Functional Analysis of an mRNP Complex That Mediates the High Stability of Human β-Globin mRNA. Mol Cell Biol 21, 5879–5888 (2001).
- La fièvre du super-congélo, effet secondaire du vaccin contre le Covid-19. Le Monde.fr (2020).
- Dahm, R. Friedrich Miescher and the discovery of DNA. Developmental Biology 278, 274–288 (2005).
- Jacob, F. & Monod, J. Genetic regulatory mechanisms in the synthesis of proteins. J Mol Biol 3, 318–356 (1961).
- Gros, F. et al. Unstable ribonucleic acid revealed by pulse labelling of Escherichia coli. Nature 190, 581–585 (1961).
- Lane, C. D., Marbaix, G. & Gurdon, J. B. Rabbit haemoglobin synthesis in frog cells: the translation of reticulocyte 9 s RNA in frog oocytes. Journal of Molecular Biology 61, 73–91 (1971).
- Dimitriadis, G. J. Translation of rabbit globin mRNA introduced by liposomes into mouse lymphocytes. Nature 274, 923–924 (1978).
- Martinon, F. et al. Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. European Journal of Immunology 23, 1719–1722 (1993).
- Zhou, X. et al. Self-replicating Semliki Forest virus RNA as recombinant vaccine. Vaccine 12, 1510–1514 (1994).
- Boczkowski, D., Nair, S. K., Snyder, D. & Gilboa, E. Dendritic cells pulsed with RNA are potent antigen-presenting cells in vitro and in vivo. Journal of Experimental Medicine 184, 465–472 (1996).
- Ying, H. et al. Cancer therapy using a self-replicating RNA vaccine. Nat Med 5, 823–827 (1999).
- Karikó, K., Buckstein, M., Ni, H. & Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA. Immunity 23, 165–175 (2005).
- Bonehill, A. et al. Enhancing the T-cell Stimulatory Capacity of Human Dendritic Cells by Co-electroporation With CD40L, CD70 and Constitutively Active TLR4 Encoding mRNA. Molecular Therapy 16, 1170–1180 (2008).
- Chahal, J. S. et al. Dendrimer-RNA nanoparticles generate protective immunity against lethal Ebola, H1N1 influenza, and Toxoplasma gondii challenges with a single dose. PNAS 113, E4133–E4142 (2016).
- Petsch, B. et al. Protective efficacy of in vitro synthesized, specific mRNA vaccines against influenza A virus infection. Nat Biotechnol 30, 1210–1216 (2012).
- Lindgren, G. et al. Induction of Robust B Cell Responses after Influenza mRNA Vaccination Is Accompanied by Circulating Hemagglutinin-Specific ICOS+ PD-1+ CXCR3+ T Follicular Helper Cells. Frontiers in Immunology 8, 1539 (2017).
- Pardi, N. et al. Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination. Nature 543, 248–251 (2017).
- Pardi, N. et al. Administration of nucleoside-modified mRNA encoding broadly neutralizing antibody protects humanized mice from HIV-1 challenge. Nat Commun 8, 14630 (2017).
- Alberer, M. et al. Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial. The Lancet 390, 1511–1520 (2017).
- Bahl, K. et al. Preclinical and Clinical Demonstration of Immunogenicity by mRNA Vaccines against H10N8 and H7N9 Influenza Viruses. Mol Ther 25, 1316–1327 (2017).
- Du, L. et al. The spike protein of SARS-CoV — a target for vaccine and therapeutic development. Nat Rev Microbiol 7, 226–236 (2009).
- Saiki, R. K. et al. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science 239, 487–491 (1988).